ترشوندگی پارامتری است که با استفاده از آن میزان آبگریزی و یا آب دوستی یک سطح را بررسی می کنند. در این مقاله قصد داریم عوامل موثر بر خاصیت ترشوندگی را بررسی کنیم.
دنیای اطراف ما از اتمها و مولکولها تشکیل شده است. الکترونهای ظرفیت یک عنصر می توانند رفتار شیمیایی عنصر را تعیین کنند. بنابراین اگر لایه ظرفیت عنصری در حالت پایدار نباشد (اوربیتال آخر آن کاملاً پر نباشد)، آن عنصر تمایل به انجام واکنش و رسیدن به یک وضعیت پایدار را دارد. عناصر به شیوه مختلفی می توانند با یکدیگر پیوند دهند. پیوندهای یونی، کوالانسی، فلزی از جمله این نیروها هستند.
علاوه بر نیروهای درون مولکولی، نیرو های بین مولکولی نیز وجود دارند. همانطور که از اسمشان مشخص است، این نوع نیروها بین دو یا چند مولکول وجود دارند. این نیروها میتوانند نیروهای همچسبی (Cohesive) یا دگرچسبی (Adhesive) باشند. در نیروهای همچسبی، مولکولهای یک جنس به همدیگر میچسبند و در دگرچسبی مولکولهای از جنسهای مختلف به همدیگر میچسبند.
مکانیزم عملکرد این نیروها بر حسب نیروهای واندروالسی است. نیروهای واندروالسی به دلیل وجود قطب مثبت و منفی و درنتیجه میدان الکتریکی باعث ایجاد نیروی جاذبه یا دافعه می شوند. بنابراین جنس این نیروها از نوع الکترواستاتیکی است. این پدیده در اصطلاح علمیاش قطبی شدن نام دارد. به صورت اجمالی ، نیروهای بین مولکولی از نیروهای درون مولکولی بسیار ضعیفتر هستند و بنابراین برای شکست یا تشکیل آنها انرژی کمتری نیاز است.
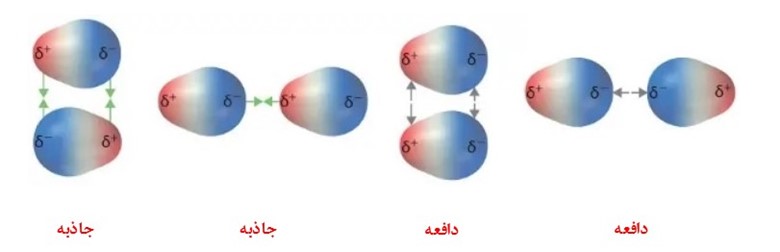
شکل 1: انواع نیروهای بین مولکولی درمولکولهای قطبی؛ نیروی جاذبه میان قطبهای ناهمنام و نیروی دافعه میان قطبهای همنام.
مولکول آب به عنوان یکی از فراوانترین مولکولهای موجود و ویژگی های متنوع از جمله دمای نقطه ذوب و جوش، ظرفیت گرمایی ویژه، چگالی، فراوانی، قطبی بودن و بسیاری ویژگی ها جذاب دیگر یک ماده پرکاربرد در صنعت و علم می باشد. علاوه بر استفاده از آب به عنوان حلال، بدلیل ارزانی و فراوانی، از آن برای بررسی قطبی یا ناقطبی بودن، آبدوستی و آبگریزی و سنجش شدت نیروی همچسبی و دگرچسبی مواد نسبت به یکدیگر نیز استفاده میشود.
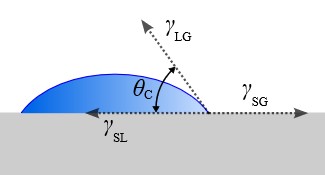
شکل 2: تصویر یک قطره آب بر روی یک سطح آب دوست که زاویه تماس بزرگی دارد.
همانطور که از عبارت ترشوندگی مشخص است، توانایی تر یا خیس کردن یک مایع، یک ویژگی باطنی آن است که بیان می کند که آیا مایع مورد نظر اگر در تماس با جامدی قرار بگیرد تمایل دارد با سطح آن تماس یابد یا خیر. همانطور که اشاره شد، جنس این نوع نیروها، الکترواستاتیکی است که یعنی دو قطب مثبت و منفی به یکدیگر نیروی جاذبه یا دافعه وارد می کنند. برای درک بهتر می توان قطبهای آهنربا را در نظر گرفت که اگر قطبها همنام باشند یکدیگر را دفع و اگر ناهمنام باشند، همدیگر را جذب می کنند. این سطح تماس در یک بازه ای از کمترین تا بیشترین تعریف می شود، به گونهای که اگر دو مایع با یک سطح معین جامد در تماس قرار بگیرند، بدیهی است مایعی که سطح تماس بیشتری با جامد داشته باشد، سیالِ تَر است.
نحوه بررسی مقدار سطح تماس با اندازی گیری زاویه تماسی است که سیال با سطح می سازد. یعنی اگر یک قطره آب بر روی یک سطحی از جنس استیل ضد زنگ (مثلاً سینک ظرفشویی) ریخته شده باشد، این قطره امکان نفوذ به داخل فلز را ندارد، از طرفی این قطره نمی تواند روی تمامی سطح پخش بشود، بنابراین روی سطح به صورت قطره باقی می ماند. این قطره از سطح تماس کاملا صاف است ولی سطح بیرونی آن دارای انحنا است. زاویهای که سطح فلز با خط مماس گذرنده از اولین مولکول قطره می سازد ملاک تر بودن یا نبودن سیال است. اگر این زاویه کمتر از 90 باشد سیال ما غیر تَر است و اگر بیشتر از آن باشد سیال، تَر است.
به طور کلی عوامل موثر بر ترشوندگی به دو دسته تقسیم بندی می شوند. دسته اول با تغییر خود ماده حل شونده، مثل اتمهای سازنده آن نیروهای بین مولکولی را تحت تاثیر قرار می دهند. این نیروها به طور کلی به سه دسته برهمکنش دوقطبی-دوقطبی، نیروی لاندن و پیوند هیدروژنی تقسیم می شوند. اگر بخواهیم نیروی بین مولکولی را افزایش دهیم، باید با تغییر شکل مولکولی، ساختار ماده را به گونهای انتخاب کنیم که سطح تماس مولکول های افزایش یابد. به زبانی دیگر، مولکول هرچقدر خطیتر باشند و کروی نباشند، سطح تماس افزایش می یابد. به عنوان مثال مولکولی مانند متان با فرمول شیمیاییCH4 مولکولی کاملا غیرقطبی است زیرا که هندسهای کاملا متقارن دارد ولی مولکول دی کلرو متان CH2Cl2 مولکولی قطبی است چون از لحاظ هندسی متقارن نیست.
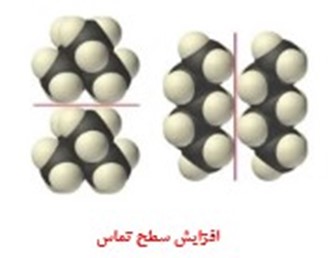
شکل 3: مقایسه میان سطح تماس در مولکول¬های کروی شکل و خطی.
همچنین هرچقدر مولکول سنگینتر و بزرگتر باشد، نیروی دافعه الکترونها تاثیر کمتری خواهد داشت. همچنین در پیوند هیدروژنی هرچقدر تعداد هیدروژنهای متصل به اتم های فلوئور (F) اکسیژن (O) نیتروژن (N) و کلر (Cl) بیشتر باشد، نیرو وارده بیشتر می شود. مثلا مولکول NH3 به دلیل الکترونگاتیوی بالای F ابر الکترونی در اطراف اتم فلئور بیشتر است که یعنی به اصطلاح قطب منفی مولکول است. بنابراین می تواند به قطبهای مثبت دیگر مولکولها بهراحتی بچسبد.

شکل 4: دی کلرومتان یک مولکول قطبی است و متان ک غیرقطبی است.
در دسته دوم می توان با ایجاد نقوص ساختاری، افزایش دما و حرارتدهی، میدان الکتریکی خارجی، کرنش کششی و مورفولوژی سطحی به بهبود ترشوندگی کمک کرد. به گونهای که اگر سطح از لحاظ مورفولوژی، سطحی متخلخل باشد، مولکولهای سیال با نفوذ بیشتر به داخل ساختار باعث افزایش قدرت ترشوندگی می شوند. به عنوان مثال می توان به خوردگی آهن اشاره کرد. آهن در حضور عوامل اکسنده خورده می شود. اگر الکترولیت با آهن سطح تماس بیشتری داشته باشد، بدیهی است که خوردگی شدیدتر می شود. همین پدیده در علم الکتروشیمی و خوردگی که در سطوح متخلخل رخ می دهد، خوردگی پیتینگ (Pitting) نام دارد.
همچنین اگر به سیال و سطح گرما بدهیم و دمای آن را افزایش دهیم، ویسکوزیته سیال کاهش یافته و راحتتر جاری می شود و در پی آن هم ترشوندگیاش بهبود میابد. یک مثال ساده برای درک بهتر این موضوع مقایسه ترشوندگی کره جامد و کره مایع است. کره جامد به سختی بر روی نان میچسبد ولی کره مایع به راحتی می تواند به نان بچسبد.

