دستگاه DCS مبتنی بر اندازهگیری توان الکتریکی
دستگاه DCS مبتنی بر اندازهگیری توان الکتریکی، تغییرات آنتالپی نمونه را در حین تحولات حرارتی به طور مستقیم اندازهگیری میکند. دستگاه DCS مبتنی بر اندازهگیری توان الکتریکی، برای نمونه و مرجع دو محفظه جداگانه دارد و برای هر محفظه، المنتهای گرمایی ویژهای تعبیه شده است؛ اندازهگیری دمای هر محفظه به صورت جداگانه انجام میشود (شکل ۱) که این نکته مبنای تفاوت آن با طراحی دستگاه آنالیز حرارتی افتراقی (DTA) است. در این دستگاه تا زمانی که در نمونه تغییر فاز رخ ندهد، سرعت گرم شدن نمونه و مرجع یکسان است.
در نتیجه دمای نمونه نسبت به دمای مرجع کاهش مییابد. دستگاه همزمان این اطلاعات را ثبت میکند. در این حالت یکی از محفظهها با کاهش دما رو به رو است در حالی که دمای محفظه دیگر در حال افزایش است. این کاهش تا جایی ادامه پیدا میکند که اختلاف بین دمای مرجع و نمونه ثابت شود که اصطلاحا تعادل صفر (null balance) نامیده میشود. برای بقای تعادل صفر، مقدار گرمایی که در واحد زمان توسط المنتهای الکتریکی ایجاد میشود، باید با مقدار گرمایی مورد نیاز نمونه در هر واحد زمان باشد. به عبارت دیگر زمانی که نمونه متحمل تحول حرارتی بشود، توان الکتریکی المنت حرارتی باید به نوعی تغییر کند که بتواند دمای نمونه را در حد دمای مرجع حفظ کند. بر همین اساس، تحول حرارتی گرماگیر، باعث افزایش توان المنت حرارتی میشود تا به نمونه گرمادهی شود. چیزی که مهم است این است که مقدار تغییر توان الکتریکی باید برابر با انرژی جریان گرما باشد تا بتواند آزاد کردن گرما یا گرفتن گرما توسط نمونه را جبران کند.
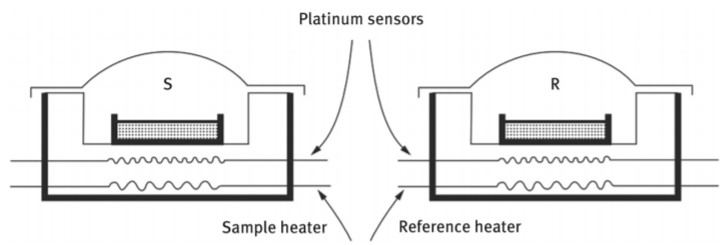
شکل ۱: شماتیک دستگاه DCS مبتنی بر اندازهگیری توان الکتریکی؛ محفظه S همان محل قرارگیری نمونه است و محفظه R محل قرارگیری مرجع است.
دستگاه DCS مبتنی بر اندازهگیری شار حرارتی
در دستگاه DCS مبتنی بر اندازهگیری شار حرارتی، فقط از یک محفظه برای نگهداری نمونه استفاده میشود (شکل ۲). اطلاعات گرمایی مواد استاندارد به عنوان مرجع در یک نرمافزار کامپیوتری ذخیره شده است. دمای نمونه توسط ترموکوپل اندازهگیری میشود و با دادههای مرجع موجود در نرمافزار کامپیوتری مقایسه میشود.
به آنالیز DSC مبتنی بر اندازهگیری شار حرارتی، آنالیز حرارتی افتراقی مقداری هم میگویند؛ زیرا اصولی مشابه با DTA دارد؛ یعنی اختلاف دما را به صورت مستقیم اندازهگیری میکند و سپس آن را به اختلاف جریان حرارت تبدیل میکند. این تبدیل با استفاده از روشهای محاسبات عددی در نرمافزار رایانهای انجام میشود که در دستگاه نصب شده است.
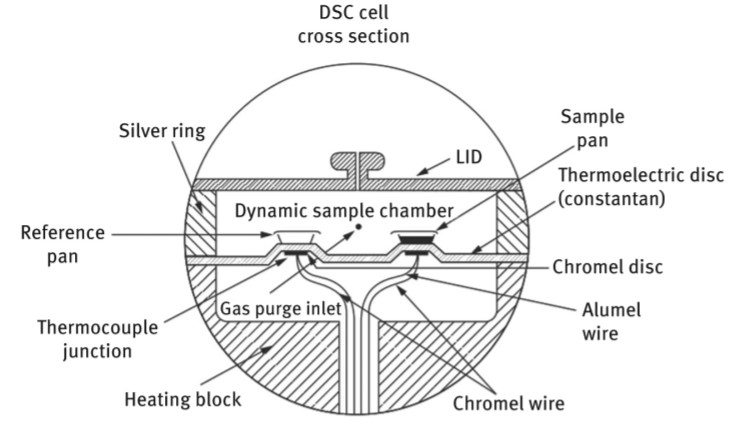
شکل ۲: شماتیک دستگاه DCS مبتنی بر اندازهگیری شار حرارتی.
نمودارهای DSC
به نمودار نتایج DSC معمولا ترموگرام گفته می شود. در ترموگرامهای DSC معمولا جریان گرما بر حسب دما است. جریان گرما یک واحد انرژی در واحد زمان در واحد جرم دارد که معمولا با واحد g.W-۱ نشان داده میشود. ترموگرامهای DSC میتوانند تحولهای حرارتی که ماده در اثر افزایش دما تجربه میکند را نشان دهد.
این تحولهای حرارتی هریک به صورتی خاص در نمودار ظاهر میشوند، برای نمونه به شکل ۳ ترموگرام DSC یک ماده فرضی است که تحولهای حرارتی را تجربه کرده است، نشان داده است. تحولهای حرارتی که یک ماده در طول فرایند حرارتدهی تجربه میکند، عبارت است از گذار جامد-جامد، بلوری شدن، ذوب شدن، انتقال شیشه، اکسید شدن و تجزیه شدن.
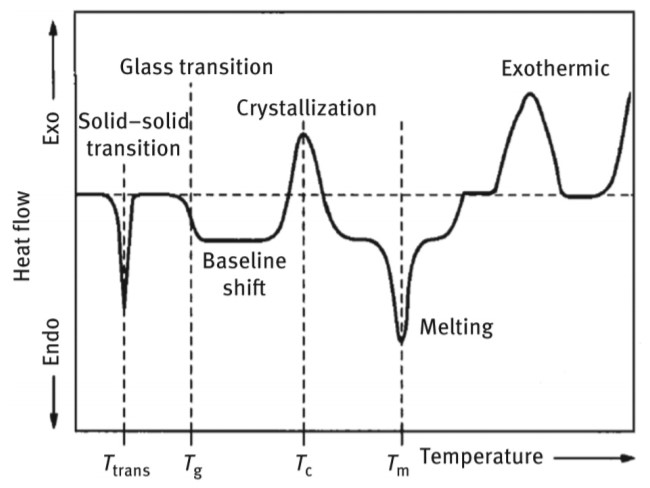
شکل ۳: یک نمونه ترموگرام برای یک ماده فرضی که گذارهای مختلف را تجربه کرده است.
در ترموگرام شکل ۳، اولین پیک مربوط به گذار جامد – جامد ماده است که در دمای Ttrans (یا دمای گذار) رخ داده است، سپس ترموگرام با یک مرحلهی گرماگیر کوچک ادامه پیدا کرده است و انتقال شیشهای در دمای Tg (یا دمای انتقال شیشه ای) رخ داده است. سپس با افزایش دما تا Tc (یا دمای تبلور)، یک پیک گرماده در نمودار ظاهر شده است که مربوط به تبلور ماده است. بسیاری از فرایندهای گفته شده برای مواد مختلف در دمایی پایینتر از دمای اتاق اتفاق میافتد. در ادامه، با افزایش دمای ماده تا دمای Tm (یا دمای ذوب)، یک پیک گرماگیر ظاهر شده است که در این نقطه ماده جامد به حالت مایع تبدیل میشود. رسیدن به دمای ذوب نتیجه بسیار مهمی برای مشخصهیابی هر ماده ای است که به راحتی از ترموگرامهای DSC قابل استخراج است.
در بسیاری از موارد، یک پیک گرماده بعد از پیک گرماگیر ذوب اتفاق میافتد. در این حالت ماده تجزیه میشود و پیک در دمای Tdec (دمای تجزیه) اتفاق میافتد. البته درمورد برخی از پلیمرها، پیک گرماده اول بعد از پیک گرماگیر ذوب، مربوط به شبکهای شدن پلیمر (یا برقرار شدن اتصالات عرضی بین زنجیرههای پلیمری) است که اصطلاحا پیک پخت (curing) هم گفته میشود. بعد از این پیک، با افزایش دما در نمونه، مجدد یک پیک گرماده ایجاد میشود که این پیک مربوط به تجزیه ماده است.
این نمودارها در مواد مختلف بر حسب نوع استحاله هایی که ممکن است در ماده رخ داده باشد، متفاوت است و برخی از پیک های بالا ممکن است در ترموگرام دیده نشوند.

