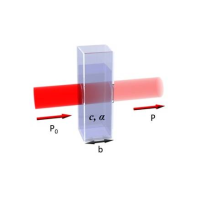
نمونه طیف سنجی مرئی-فرابنفش
برای بررسی یک نمونه با طیف سنجی مرئی-فرابنفش، از آن ماده یک محلول رقیق با غلظت برابر با c تهیه میکنند و آن را درون محفظه نمونه دستگاه یا اصطلاحا سِل (cell) میریزند. معمولا این سِل یک محفظهای به شکل مکعب مستطیل با ضخامت برابر با b است.
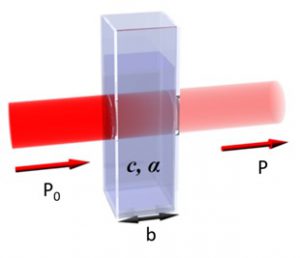
شکل ۱: یک نمونه سل اسپکتروفتومتر فرابنفش-مرئی در حال عبور امواج الکترومغناطیسی از ضخامت سِل.
عبور در طیف سنجی مرئی-فرابنفش
بعد از قراردادن سِل در دستگاه اسپکتروفتومتر، امواج فرابنفش در راستای ضخامت سِل برخورد میکند و درنتیجه برهمکنش بین فوتونها و ذرات جاذب نمونه، توان باریکهی امواج الکترومغناطیسی از P۰ به P کاهش مییابد. کاهش توان به خاطر عبور (T) امواج الکترومغناطیسی ورودی به نمونه است. عبور (T) عبارت است از:
T = P/P۰
عبور را معمولا برحسب درصد و به صورت زیر بیان میکنند:
%T = (P/P۰)*۱۰۰
جذب در طیف سنجی مرئی-فرابنفش
درون دستگاه اسپکتروفتومتر، با برخورد باریکه امواج فرابنفش، در حین عبور، در نمونه جذب هم صورت میگیرد. به عبارت دیگر، کاهش توان باریکه بعد از عبور با جذب نمونه رابطه مستقیم دارد؛ بنابراین هرچه تضعیف توان باریکه بیشتر شود، میزان جذب در نمونه بیشتر میشود. به طور کلی رابطه جذب نور (A) یک محلول با معادله زیر تعریف میشود:
(A = -log T = log (P۰/P
در رابطه بالا، T مخفف عبارت Transmittance است که میزان عبور را نشان میدهد.
در دستگاه اسپکتروفتومر فرابنفش-مرئی همانطور که گفته شد، نمونهها عموما به صورت محلولهای بسیار رقیق هستند. بنابراین برای بررسی ارتباط بین جذب نمونه و غلظت نمونه از قانون بیر-لامبرت استفاده میشود، زیرا این قانون تنها در توصیف رفتار جذب محلولهای رقیق کارا است. معمولا در محلولهایی که غلظتی بیشتر از ۰.۰۱ مولار دارند، فاصلههای میانگین بین ذرات جاذب به قدری کم است که هر ذره بر توزیع بار ذرات مجاور خود اثر میگذارد. همین برهمکنش بین ذرات، توانایی ذرات را برای جذب یک طول موج معین تابشی تغییر میدهد.
براساس قانون بیر-لامبرت، جذب نمونه به طور مستقیم با طول مسیر عبور نور از نمونه یا همان ضخامت سِل در راستای عبور نور (b) و غلظت محلول (c) متناسب است. بنابراین داریم:
A = log (P۰/P) = α*b*c
در رابطه بالا، α یک ثابت تناسب است و ضریب جذب نامیده میشود. اندازه α به وضوح به مقادیر به کار رفته برای b و c بستگی دارد. b اغلب برحسب سانتیمتر (cm) و c برحسب گرم بر لیتر (g/L) داده میشود. بنابراین واحد ضریب جذب برابر با لیتر بر گرم بر سانتیمتر (L/g.cm) است. اگر در این معادله، غلظت محلول برحسب مولار (mol/L) باشد، و طول مسیر عبور نور درون سِل برحسب سانتیمتر (cm) باشد، ضریب جذب را ضریب جذب مولی گویند و با نماد ε نشان میدهد. واحد ε برابر با لیتر بر مول بر سانتیمتر (L/mol.cm) است. بنابراین معادله به شکل زیر تغییر مییابد:
A = ε*b*c
به طور کلی اگر تغییراتی در غلظت محلول صورت بگیرد، ضریب شکست محلول تغییر میکند و از آنجایی که ضریب جذب مولی محلول به ضریب شکست محلول بستگی دارد، بنابراین ضریب جذب مولی محلول هم دچار تغییر میشود. بنابراین اگر تغییرات غلظتی محلول باعث تغییرات قابل توجه در ضریب شکست محلول بشود، آنگاه انحراف از قانون بیر-لامبرت مشاهده میشود. به طور کلی این اثر در غلظتهای کمتر ۰.۰۱ مولار قابل توجه است.
قانون بیر-لامبرت برای محلولهای حاوی بیش از یک نوع جسم جاذب نیز قابل استفاده است. در صورتی که برهمکنشی بین گونههای مختلف وجود نداشته باشد، جذب کل سامانهی چند جزئی به صورت رابطه زیر قابل محاسبه است:
A۱ + A۲ + … + An = ε۱bc + ε۲bc + … + εnbc =کلA
زیروندهای ۱ تا n در رابطه بالا، اشاره به جاذبهای مختلف حاضر در محلول اشاره دارد.
طبق رابطه بالا، جذب کل یک مخلوط چند جرئی در طول موج معین برابر با مجموع جذب هر یک از اجزای سازنده منفرد موجود در مخلوط است. با وجودِ این رابطه، امکان تعیین کمّی اجزای سازنده منفرد یک مخلوط (حتی اگر طیف همپوشانی هم داشته باشد)، میسر است. در شرایطی که رابطه بیر-لامبرت برای مخلوط های چندجزئی اعتبار داشته باشد، بیشترین دقت زمانی اتفاق میافتد که تفاوت در ضرایب جذب مولی در طول موجهای انتخاب شده، زیاد باشد.
مخلوطهای حاوی بیش از دو گونه جاذب را از نظر اصولی میتوان با حداقل یک اندازهگیری جذب دیگر برای هر جزء سازندهی اضافی آنالیز کرد. با وجود این، با افزایش تعداد اندازهگیریها، خطاها در دادههای حاصل بزرگتر میشود. البته برخی از طیفسنجهای کامپیوتری قادرند این خطاها را تا حدی کاهش دهند. البته در این روشها به طیف محلول استاندارد هر جزء سازنده نیاز است.
مهامکس در زمینه تحلیل و تفسیر و انجام آنالیز طیف سنجی آماده ارائه خدمات به شما است. برای اطلاعات بیشتر می توانید به بخش آنالیز طیف سنجی مراجعه کنید.